
Structura silicatului de sodiu (Na2SiO3), proprietăți, utilizări, riscuri

silicat de sodiu este un compus anorganic format din doi ioni de sodiu Na+ și un anion silicat SiO3Două-. Se spune, de asemenea, că este alcătuit dintr-o moleculă de silice SiODouă și un oxid de sodiu NaDouăO. Formula sa chimică poate fi exprimată ca NaDouăda3 sau, de asemenea, NaDouăSAU.daDouă.
Cu toate acestea, compoziția silicatului de sodiu poate varia în funcție de raportul SiODouă/ N / ADouăFie în greutate, fie în alunițe. Se mai numește silicat solubil sau sticlă de apă. Poate fi obținut sub formă de pulbere, bucăți mari asemănătoare cristalului sau sub formă de soluții.

Silicatul de sodiu este utilizat pe scară largă în detergenți și săpunuri, deoarece înmoaie apa, făcând curățarea mai eficientă. De asemenea, face parte din produse precum crema de bărbierit.
Este materia primă pentru prepararea catalizatorilor de silice SiODouă. Soluțiile sale sunt utilizate ca adeziv în multe aplicații, de la hârtie adezivă și carton, până la sticlă, porțelan, matrițe refractare, ciment și discuri abrazive..
Deoarece este un material complet necombustibil, este folosit pentru fabricarea țesăturilor ignifuge, deoarece este ignifug și ca strat de acoperire pentru echipamentele de protecție..
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Densitatea
- 3.5 Solubilitate
- 3,6 pH
- 3.7 Proprietăți chimice
- 3.8 Alte proprietăți
- 4 Obținerea
- 5 utilizări
- 5.1 În săpunuri și detergenți
- 5.2 În catalizatori și geluri de silice
- 5.3 Ca adeziv sau lipici
- 5.4 În fluidele de forare a puțurilor de petrol
- 5.5 În diverse aplicații
- 6 Riscuri
- 7 Referințe
Structura
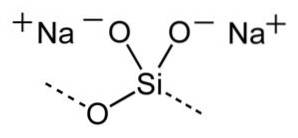
Formula generală pentru silicații de sodiu este xSiODouă/ N / ADouăSau unde x este raportul molar sau greutate.
Raportul molar înseamnă numărul de moli de SiODouă împărțit la numărul de moli de NaDouăO. Raportul de greutate înseamnă greutatea de SiODouă împărțit la greutatea NaDouăSAU.
Adăugarea mai multor alcaline (NaDouăO) se modifică raportul molar sau greutate.
O soluție de silicat de sodiu cu un raport molar scăzut, de exemplu 1/1 (1 mol de SiODouă și 1 mol de NaDouăO) conține în principal monomeri SiO44- și dimerii SDouăSAU5Două- pe lângă ionii de Na+.
O soluție cu un raport molar ridicat, cum ar fi 3,3 / 1 (3,3 moli de SiODouă pentru fiecare mol de NaDouăO) are o proporție mare de specii polimerice sau polimeri de siliciu și oxigen.
Nomenclatură
-Silicat de sodiu
-Metasilicat de sodiu
-Sticlă solubilă
-Pahar cu apă (din engleză pahar de apa)
-Silicat solubil
Proprietăți
Starea fizică
-Solid în bucăți mari, care seamănă cu cristale verzuie-albăstrui
-Solid incolor până la alb praf
-Soluții apoase incolore.
Greutate moleculară
Din formula NaDouăda3: 122,063 g / mol.
Punct de topire
N / ADouăda3: 1089 ° C
Densitate
Depinde de raportul SiODouă/ N / ADouăSAU.
Solubilitate
Când este sub formă de bucăți mari de cristal verzui, este solubil în apă dacă este încălzit și sub presiune ridicată. Pulberea este puțin mai solubilă, dar în ambele cazuri solubilitatea sa depinde de cantitatea de sodiu sau NaDouăSau că deține.
Cu cât conținutul de sodiu este mai mare (sub formă de NaDouăO) se dizolvă mai repede.
pH
Soluțiile sale apoase sunt puternic alcaline.
Proprietăți chimice
Pregătit comercial în relațiile SiODouă/ N / ADouăSau în greutate variind de la 1,5 la 3,3. Pe măsură ce SiO creșteDouă în relație scade solubilitatea în apă și alcalinitate.
Dizolvarea silicatului solid în apă poate forma amestecuri gelatinoase sau foarte vâscoase.
Pudra de silicat de sodiu poate fi deliquescentă, adică dacă are o cantitate mare de NaDouăSau, tinde să absoarbă cu ușurință apa din mediu.
Dacă pH-ul soluțiilor sale este redus prin adăugarea de acid, se formează un gel.
Alte proprietăți
Nu este inflamabil.
Obținerea
Nisipul de silice SiO este topit pentru a obține silicați de sodiuDouă cu carbonat de sodiu NaDouăCO3 anhidru la cuptor deschis. Raportul molar dintre nisip și carbonat de sodiu poate varia comercial de la 0,5 la 3,75.

Aplicații
În săpunuri și detergenți
Silicații de sodiu sunt printre primii compuși care au fost utilizați în formulările de detergenți.

Silicatul de sodiu sechestrează ionii de calciuDouă+ și magneziu MgDouă+, eliminând ceea ce se numește duritatea apei, adică înmoaie-o. Făcând acest lucru, se formează precipitate insolubile, deci este utilizat în cantități mici.
Acțiunea silicatului de sodiu permite detergentului să funcționeze fără ca ionii menționați să afecteze procesul de curățare.
În geluri de siliciu și catalizatori
Gelurile de silice se prepară în mod obișnuit prin acidificarea unei soluții de silicat de sodiu la un pH mai mic de 10 sau 11. Timpul necesar gelului variază..

Silica poate fi preparată prin amestecarea silicatului de sodiu cu un acid mineral puternic. Silicatul de sodiu este utilizat la fabricarea bazelor pentru catalizatori, deoarece este sursa de silice SiODouă.
Ca adeziv sau lipici
Soluțiile apoase concentrate de silicat de sodiu sunt utilizate ca adezivi și etanșanți. Ele pot rezista la temperaturi de până la 1100 ° C.
Principalele aplicații ale lipiciilor de silicat de sodiu sunt în hârtie adezivă, carton ondulat sau ondulat, cutii și cutii. De asemenea, pentru lipirea sau aglomerarea lemnului sau pentru aderarea metalului la diferite tipuri de materiale.

Se folosește pentru lipirea sticlei, porțelanului, ceramicii, textilelor, pielii etc. Pentru lipirea fibrelor de sticlă, sticlei optice și recipientelor din sticlă rezistentă la impact.
Permite prepararea cimenturilor refractare pentru a construi rezervoare, ceainice, cuptoare și matrițe pentru turnarea metalelor, precum și pentru a face mortare sau cimenturi rezistente la apă sau acide..
Silicații de sodiu pot reacționa cu fluorurile de siliciu pentru a produce cimenturi rezistente la acid, cu o tendință scăzută de micșorare și de expansiune termică similară cu cea a oțelului..
De asemenea, sunt folosite pentru fabricarea cimenturilor pentru discurile abrazive utilizate pentru lustruire..
În fluidele de forare a puțurilor de petrol
Silicatul de sodiu a fost folosit de mulți ani ca suspensie chimică în timpul forării anumitor tipuri de formațiuni cu permeabilitate foarte mare, cum ar fi cele care sunt constituite din nisip..
Permeabilitatea ridicată înseamnă că lasă lichidele să treacă cu ușurință.
Se adaugă împreună cu un compus care activează silicatul pentru a forma un polimer. Acest polimer oferă rezistență, rigiditate și reduce permeabilitatea în solurile granulare..
Deoarece solul este mai puțin permeabil, lichidul nu trece liber prin el și astfel se pierde lichidul în timpul fazei de forare a puțului.
În diverse aplicații
Silicatul de sodiu are, de asemenea, o varietate de utilizări. Aici sunt câteva.
-În produsele de îngrijire zilnică, de exemplu, este o componentă a cremelor de bărbierit.
-În tratarea apei.
-În albirea textilelor precum lâna.
-În albirea pastei de hârtie. De exemplu, pentru decolorarea lemnului măcinat se utilizează un amestec care conține peroxid de hidrogen și silicat de sodiu printre alte ingrediente. Silicatul de sodiu este utilizat pentru sechestrarea ionilor metalici, care tind să accelereze descompunerea peroxidului..
-Pentru fabricarea țesăturilor ignifuge. Ca ignifug și ca strat de acoperire pentru echipamentele de protecție.
-În pigmenții de silice.
-Pentru a detecta boabele de porumb infestate de insecte. Un amestec de silicat de sodiu și apă este utilizat în cazul în care boabele infestate plutesc la suprafață rapid.
-În zincare.
-Pentru a curăța metalele.
-În flotația mineralelor, este utilizat ca dispersant pentru nămol și nămol și ca balsam pentru suprafața mineralelor..
-Pentru a impregna lemnul.
Riscuri
Silicatul de sodiu, datorită conținutului său ridicat de alcali, este un iritant puternic pentru piele, ochi și mucoase. Dacă este înghițit, poate fi toxic și irita membranele mucoase în mod similar cu soluțiile de sodă caustică..
Trebuie depozitat separat de acizi puternici, metale și halogeni, cum ar fi fluorul, cu care reacționează violent.
Referințe
- Ebnesajjad, S. (2015). Caracteristicile materialelor adezive. Silicați solubili (silicat de potasiu și sodiu). În Manualul de adezivi și pregătirea suprafeței. Recuperat de la sciencedirect.com.
- Fink, J.K. (2012). Aditivi pentru pierderea de lichide. Metasilicat de sodiu. În Ghidul inginerului petrolier pentru substanțele chimice și fluidele din câmpul petrolier (ediția a doua). Recuperat de la sciencedirect.com.
- S.U.A. Biblioteca Națională de Medicină. (2019). Silicat de sodiu. Centrul Național pentru Informații despre Biotehnologie. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer. (1984). Enciclopedia tehnologiei chimice, ediția a 3-a, John Wiley și Sons.
- Maeda, K. și colab. (2007). De la zeoliți la materiale poroase MOF - 40a Aniversarea Conferinței internaționale de zeolit. În studii în știința suprafeței și cataliză. Recuperat de la sciencedirect.com.
- Chopade, S.P. și Nagarajan, K. (2000). Formulări detergente: schimb ionic. În Enciclopedia Științei Separării. Recuperat de la sciencedirect.com.
- .



Nimeni nu a comentat acest articol încă.