
Structura solidelor cristaline, proprietăți, tipuri, exemple

solide cristaline Sunt cei ale căror structuri microscopice sunt ordonate și respectă un model distinctiv pentru o rețea de cristal dată; de exemplu: cubic, hexagonal, triclinic, romboedru, printre altele.
Se spune că aceste solide există ca cristale, afișând fațete și modele geometrice care reflectă cât de ordonate sunt în interior. Alte exemple de solide cristaline sunt diamantul, cuarțul, antracena, gheața uscată, clorura de potasiu sau oxidul de magneziu..

O binecunoscută pereche de solide cristaline este cea a zahărului și a sării (NaCl). La prima vedere, ambele prezintă cristale albe; dar proprietățile lor diferă enorm. Zaharul este un solid cristalin molecular, în timp ce sarea este un solid cristalin ionic. Prima este formată din molecule de zaharoză; iar al doilea, al ionilor de Na+ și Cl-.
Imaginea de mai sus oferă o privire asupra cât de strălucitoare pot fi cristalele de zahăr. Cristalele de sare, cu toate acestea, nu sunt cu mult în urmă. Deși zahărul și sarea par frați, structurile lor sunt diferite: zahărul, care este zaharoza, are o structură monoclinică; în timp ce sarea, o structură cubică.
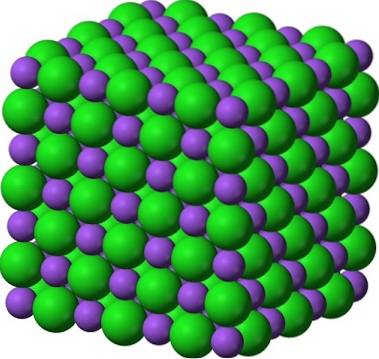
Zaharul pudra si sarea (glazura) raman cristaline; cristalele sale s-au micșorat atât de mult pentru ochii noștri. Prin urmare, cristalinitatea unui solid este definită mai mult prin structura sa internă, decât prin aspectul său exterior sau luminozitatea sa..
Indice articol
- 1 Structura solidelor cristaline
- 2 Proprietăți
- 3 Tipuri de solide cristaline
- 3.1 Ionic
- 3.2 Metalic
- 3.3 Molecular
- 3.4 Rețele covalente
- 4 Exemple
- 4.1 Ionic
- 4.2 Metalic
- 4.3 Molecular
- 4.4 Rețele covalente
- 5 Referințe
Structura solidelor cristaline
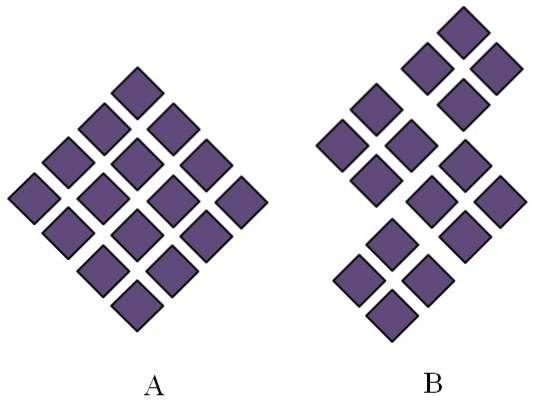
Solidele cristaline au structuri ordonate. Caracteristicile lor geometrice vor depinde de tipul de rețea cristalină căreia îi aparțin, care la rândul său este proiectat extern în formele cristalului (sistemul cristalin). Imaginea de mai sus ilustrează două concepte importante ale unor astfel de structuri: periodicitatea și boabele cristaline..
Ordinea spațială a particulelor unui solid cristalin este periodică; adică se repetă iar și iar în toate direcțiile. Acest lucru își creează propriul model structural pentru fiecare rețea solidă și cristalină; de exemplu, aici sare și zahărul încep să se diferențieze dincolo de natura lor chimică.
În A romburile sunt aranjate pentru a da naștere unui romb de proporții mai mari. Fiecare romb violet reprezintă o particulă sau un set de particule (atomi, ioni sau molecule). Astfel, un cristal macroscopic de A ar putea fi de așteptat să aibă un aspect romboedru..
Între timp, în B romburile sunt aranjate în așa fel încât să dea naștere la boabe cristaline; acestea sunt cristale foarte mici (cristalite). Se spune apoi că B este un solid policristalin; adică este format din aglomerarea cristalitelor multiple.
În concluzie, un solid poate fi pur și simplu cristalin (A) sau policristalin (B); A formează cristale, în timp ce B policristale.
Proprietăți
Proprietățile solidelor cristaline depind de tipul lor de cristal. Se știe deja că structurile lor sunt ordonate și că au și tendința de a prezenta trăsături luminoase de care se îndrăgostesc iubitorii de minerale. Cu toate acestea, s-a menționat că un solid pulbere, chiar „oprit”, poate fi clasificat și ca cristal..
Modul în care particulele lor sunt orientate spațial le permite să aibă unele proprietăți importante pentru caracterizarea lor. De exemplu, solidele cristaline sunt capabile de difracție a razelor X, creând spectre de difracție din care poate fi determinată structura microscopică a unui cristal..
De asemenea, deoarece structura este periodică, căldura se difuzează în același mod în întregul solid; atâta timp cât nu există impurități implicate. Astfel, punctele de topire pentru un solid cristalin sunt constante și nu variază indiferent de modul în care sunt măsurate..
Tipuri de solide cristaline
Tipurile de solide cristaline se bazează pe ce tip de particule sunt formate și care sunt interacțiunile sau legăturile lor. Există în esență patru tipuri: rețele ionice, metalice, moleculare și covalente.
Chiar și atunci când prezintă un anumit grad de impurități, acestea continuă să fie cristaline, chiar dacă proprietățile lor sunt afectate și nu prezintă aceleași valori așteptate pentru un solid pur..
Ionice
Sarea este un exemplu de solid cristalin ionic, deoarece este compus din ioni Na+ și Cl-. Prin urmare, în acest tip de solide guvernează legătura ionică: forțele electrostatice sunt cele care guvernează ordonarea structurală..
Metalic
Toți atomii metalici formează cristale metalice. Aceasta înseamnă că, de exemplu, o furcă de argint este un conglomerat de cristale de argint topite. Structura internă sau microscopică este aceeași în fiecare întindere a obiectului și rămâne neschimbată de la mânerul furculiței până la vârful dinților..
Molecular
Zaharul este un exemplu de solid cristalin molecular, deoarece este alcătuit din molecule de zaharoză. Prin urmare, acest tip de solid este alcătuit din molecule, care prin interacțiunile lor intermoleculare (și nu legături covalente) reușesc să stabilească o structură ordonată..
Rețele covalente
În cele din urmă, avem solidele cristaline ale rețelelor covalente. Legăturile covalente predomină în ele, deoarece acestea sunt responsabile pentru stabilirea unei ordine și menținerea atomilor puternic fixați în pozițiile lor spațiale respective. Nu vorbim despre ioni, atomi sau molecule, ci despre rețele tridimensionale.
Exemple
Apoi, și în cele din urmă, vor fi citate câteva exemple pentru fiecare dintre tipurile de solide cristaline.
Ionice
Toate sărurile sunt solide ionice. La fel, există sulfuri, hidroxizi, oxizi, halogenuri și alți compuși care sunt, de asemenea, alcătuite din ioni sau interacțiunile lor sunt în esență ionice. Deci avem:
-KCl
-Caz4
-Ba (OH)Două
-CURS4
-FeCl3
-N / ADouăS
-MgO
-CaFDouă
-NaHCO3
-(NH4)DouăCrO4
În plus față de aceste exemple, marea majoritate a mineralelor sunt considerate solide cristaline ionice.
Metalic
Orice element metalic apare în mod natural ca cristale metalice. Unii dintre ei sunt:
-Cupru
-Fier
-Aluminiu
-Crom
-Hidrogen metalic (sub presiuni inimaginabile)
-Tungsten
-Zirconiu
-Titan
-Magneziu
-Sodiu
Molecular
Există o mare varietate de solide moleculare cristaline. Practic orice compus organic care se solidifică poate crea cristale dacă puritatea sa este mare sau dacă structura sa nu este prea complicată. Deci avem:
-Gheață (HDouăSAU)
-Gheață uscată (CODouă)
-EuDouă
-P4
-S8 (și polimorfii săi)
-Antracen
-Oxigen solid
-Amoniac solid
-Fenolftaleina
-Acid benzoic
Rețele covalente
Și, în cele din urmă, printre unele solide cristaline ale rețelelor covalente avem:
-Diamant
-Grafit
-Nanotuburi de carbon
-Fullereni
-Cuarţ
-Siliciu
-Germaniu
-Nitrură de bor
Din această listă, nanotuburile de carbon și fullerenele ar putea fi, de asemenea, considerate ca solide moleculare cristaline. Acest lucru se datorează faptului că, deși constau din atomi de carbon legați covalent, definesc unități care pot fi vizualizate ca macromolecule (mingi și tuburi de fotbal)..
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2020). Cristal. Recuperat de pe: en.wikipedia.org
- Chimie LibreTexte. (16 iunie 2019). Solidele cristaline și amorfe. Recuperat de pe: chem.libretexts.org
- Rachel Bernstein și Anthony Carpi. (2020). Proprietățile solidelor. Recuperat de pe: visionlearning.com


Nimeni nu a comentat acest articol încă.