
Structura sulfurii de cupru, proprietăți, utilizări

sulfură de cupru este o familie de compuși anorganici a căror formulă chimică generală este CuXSDa. da X Este mai mare decât Da înseamnă că sulfura menționată este mai bogată în cupru decât în sulf; iar dacă dimpotrivă, X Este mai mic decât Da, atunci sulful este mai bogat în sulf decât cuprul.
În natură predomină numeroase minerale, reprezentând surse naturale ale acestui compus. Aproape toate sunt mai bogate în cupru decât în sulf, iar compoziția lor este exprimată și simplificată prin formula CuXS; Aici X poate lua chiar valori fracționare, indicative ale unui solid non-stoichiometric (Cu1,75S, de exemplu).

Deși sulful este galben în starea sa elementară, compușii săi derivați par de culoare închisă; acesta este și cazul sulfurii de cupru. Cu toate acestea, covelita minerală (imaginea de sus), care este compusă în principal din CuS, prezintă luciu metalic și irizări albăstrui..
Acestea pot fi preparate din diferite surse de cupru și sulf, folosind diferite tehnici și variind parametrii de sinteză. Astfel, puteți obține nanoparticule CuS cu morfologii interesante.
Indice articol
- 1 Structura sulfurii de cupru
- 1.1 Legături
- 1.2 Coordonări în coveliță
- 1.3 Alte cristale
- 2 Proprietăți
- 2.1 Generalități
- 2.2 Covelit
- 3 utilizări
- 3.1 Nanoparticulele în medicină
- 3.2 Nanostiința
- 4 Referințe
Structura sulfurii de cupru
Link-uri
Acest compus are aspectul de a fi cristalin, deci se poate crede imediat că este compus din ioni Cu+ (cupru monovalent), CuDouă+ (cupru bivalent), SDouă- și, inclusiv, SDouă- și SDouăDouă- (anioni disulfuri), care interacționează prin forțe electrostatice sau legături ionice.
Cu toate acestea, există un ușor caracter covalent între Cu și S și, prin urmare, legătura Cu-S nu poate fi exclusă. Din acest raționament, structura cristalină a CuS (și cea a tuturor solidelor sale derivate) începe să difere de cele găsite sau caracterizate pentru alți compuși ionici sau covalenți..
Cu alte cuvinte, nu putem vorbi de ioni puri, dar în mijlocul atracțiilor lor (cation-anion) există o ușoară suprapunere a orbitalilor lor externi (partajarea electronilor).
Coordonări în la covelita
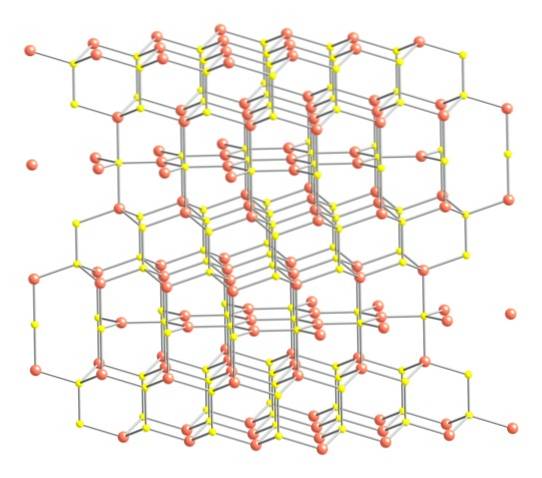
Acestea fiind spuse mai sus, structura cristalină a covelitei este prezentată în imaginea superioară. Este format din cristale hexagonale (definite de parametrii celulelor lor unitare), în care ionii se unesc și se orientează în diferite coordonări; acestea sunt, cu un număr variat de vecini apropiați.
În imagine, ionii de cupru sunt reprezentați de sfere roz, în timp ce ionii de sulf sunt reprezentați de sfere galbene..
Concentrând atenția mai întâi asupra sferelor roz, se va observa că unele sunt înconjurate de trei sfere galbene (coordonare plan trigonală), iar altele de patru (coordonare tetraedrică)..
Primul tip de cupru, trigonal, poate fi identificat în planurile perpendiculare pe fețele hexagonale orientate spre cititor, în care se află la rândul lor al doilea tip de carbon, tetraedric.
Trecând acum la sferele galbene, unele au cinci sfere roz ca vecine (coordonare bipiramidică trigonală), iar altele trei și o sferă galbenă (din nou, coordonare tetraedrică); În acesta din urmă, se vede anionul disulfid, care poate fi văzut mai jos și în aceeași structură a covelitei:
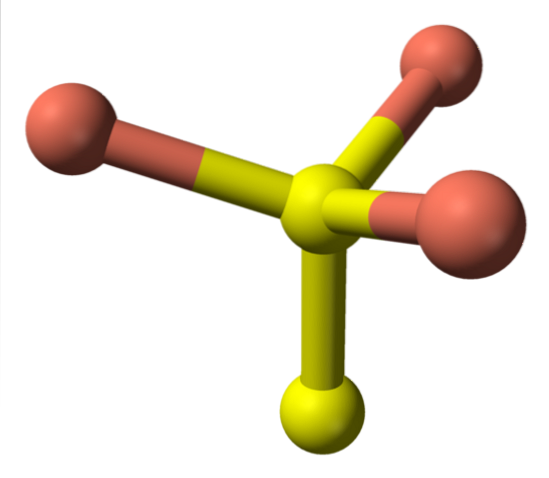
Formula alternativă
Există apoi ioni CuDouă+, Cu+, SDouă- și SDouăDouă-. Cu toate acestea, studiile efectuate cu spectroscopie fotoelectronică cu raze X (XPS), indică faptul că tot cuprul este sub formă de cationi Cu+; și, prin urmare, formula inițială CuS, este exprimată „mai bine” ca (Cu+)3(S2−) (SDouă)-.
Rețineți că raportul Cu: S pentru formula de mai sus continuă să fie 1 și, în plus, taxele se anulează.
Alte cristale
O sulfură de cupru poate adopta cristale ortorombice, ca în polimorf, γ-CuDouăS, din calcocit; cubic, ca în alt polimorf de calcocit, α-CuDouăS; tetragonal, în anilita minerală, Cu1,75S; monoclinici, în djurleita, Cu1,96Da, printre altele.
Pentru fiecare cristal definit există un mineral și, la rândul său, fiecare mineral are propriile sale caracteristici și proprietăți.
Proprietăți
General
Proprietățile sulfurii de cupru sunt supuse raportului Cu: S al solidelor sale. De exemplu, cei cu anioni S.DouăDouă- au structuri hexagonale și pot fi fie semiconductori, fie conductori metalici.
Dacă, pe de altă parte, conținutul de sulf constă doar din anioni SDouă-, sulfurile se comportă ca semiconductorii și prezintă, de asemenea, conductivități ionice la temperaturi ridicate. Acest lucru se datorează faptului că ionii săi încep să vibreze și să se miște în interiorul cristalelor, transportând astfel sarcini electrice..
Optic, deși depinde și de compoziția lor de cupru și sulf, sulfurile pot absorbi sau nu radiațiile din regiunea infraroșie a spectrului electromagnetic. Aceste proprietăți optice și electrice fac ca materialele potențiale să fie implementate în diferite game de dispozitive..
O altă variabilă de luat în considerare, pe lângă raportul Cu: S, este dimensiunea cristalelor. Nu numai că există mai mulți sulfuri de cupru „sulf” sau „cupru”, dar dimensiunile cristalelor lor conferă un efect imprecis asupra proprietăților lor; Astfel, oamenii de știință sunt dornici să studieze și să caute aplicații pentru nanoparticulele de Cu.XSDa.
Covelite
Fiecare sulfură minerală sau de cupru are proprietăți unice. Cu toate acestea, dintre toate, covelitul este cel mai interesant din punct de vedere structural și estetic (datorită irizării sale și a tonurilor albastre). Prin urmare, unele dintre proprietățile sale sunt menționate mai jos.
Masă molară
95,611 g / mol.
Densitate
4,76 g / ml.
Punct de topire
500 ° C; dar se strică.
Solubilitatea apei
3.3 10-5 g / 100 ml la 18 ° C.
Aplicații
Nanoparticulele în medicină
Nu numai că dimensiunea particulelor variază până când ating dimensiunile nanometrice, dar și morfologiile lor pot varia foarte mult. Astfel, sulfura de cupru poate forma nanosfere, tije, plăci, pelicule subțiri, cuști, cabluri sau tuburi..
Aceste particule și morfologiile lor atractive dobândesc aplicații individuale în diferite domenii ale medicinei..
De exemplu, nanocăștile sau sferele goale pot servi ca purtători de medicamente în corp. Au fost utilizate nanosfere, susținute de electrozi din sticlă de carbon și nanotuburi de carbon, pentru a funcționa ca detectoare de glucoză; precum și agregatele sale sunt sensibile la detectarea biomoleculelor precum ADN-ul.
Nanotuburile CuS depășesc nanosferele în detectarea glucozei. În plus față de aceste biomolecule, imunosenzorii au fost proiectați din filme de CuS subțiri și anumite suporturi pentru detectarea agenților patogeni..
Nanocristalele și agregatele amorfe ale CuS pot provoca chiar apoptoza celulelor canceroase, fără a provoca daune celulelor sănătoase.
Nanostiința
În subsecțiunea anterioară se spunea că nanoparticulele sale au făcut parte din biosenzori și electrozi. În plus față de astfel de utilizări, oamenii de știință și tehnicienii au profitat și de proprietățile sale pentru a proiecta celule solare, condensatori, baterii cu litiu și catalizatori pentru reacții organice foarte specifice; Elemente indispensabile în nanoștiință.
De asemenea, merită menționat faptul că, atunci când este susținut pe cărbune activ, setul NpCuS-CA (CA: Carbon Activat și Np: Nanoparticule) s-a dovedit a fi un agent de îndepărtare a coloranților dăunători oamenilor și, prin urmare, funcționează ca purificator al surselor de apa absorbind molecule nedorite.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Sulfură de cupru. Recuperat de pe: en.wikipedia.org
- Ivan Grozdanov și Metodija Najdoski. (o mie noua sute nouazeci si cinci). Proprietățile optice și electrice ale filmelor de sulfură de cupru cu compoziție variabilă. Journal of Solid State Chemistry Volumul 114, numărul 2, 1 februarie 1995, paginile 469-475. doi.org/10.1006/jssc.1995.1070
- Centrul Național pentru Informații despre Biotehnologie. (2019). Sulfură de cupru (CuS). Baza de date PubChem. CID = 14831. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Peter A. Ajibade și Nandipha L. Botha. (2017). Sinteză, proprietăți optice și structurale
- a nanocristalelor de sulfură de cupru de la precursori cu o singură moleculă. Departamentul de chimie, Universitatea din Fort Hare, Private Bag X1314, Alice 5700, Africa de Sud. Nanomateriale, 7, 32.
- Colaborare: Autori și editori ai volumelor III / 17E-17F-41C (s.f.). Sulfuri de cupru (Cu2S, Cu (2-x) S) structură cristalină, parametri de rețea. În: Madelung O., Rössler U., Schulz M. (eds) Elemente lipite non-tetraedric și compuși binari I. Landolt-Börnstein- Grupul III Materie condensată (date numerice și relații funcționale în știință și tehnologie), vol 41C. Springer, Berlin, Heidelberg.
- Momtazan, F., Vafaei, A., Ghaedi, M. și colab. Coreeanul J. Chem. Eng. (2018). Aplicarea nanoparticulelor de sulfură de cupru încărcate cu cărbune activ pentru adsorbția simultană a coloranților ternari: metodologia suprafeței de răspuns. 35: 1108. doi.org/10.1007/s11814-018-0012-1
- Goel, S., Chen, F. și Cai, W. (2014). Sinteza și aplicațiile biomedicale ale nanoparticulelor de sulfură de cupru: de la senzori la teranostice. Mic (Weinheim an der Bergstrasse, Germania), 10 (4), 631-645. doi: 10.1002 / smll.201301174


Nimeni nu a comentat acest articol încă.