
Structura, proprietățile și utilizările sulfurii de zinc (ZnS)
sulfură de zinc este un compus anorganic cu formula ZnS, format din cationi ZnDouă+ și anioni SDouă-. Se găsește în natură în principal ca două minerale: wurtzite și sphalerite (sau blende de zinc), aceasta din urmă fiind forma sa principală.
Sphalerita este de culoare neagră datorită impurităților pe care le prezintă. În forma sa pură, are cristale albe, în timp ce wurtzita are cristale alb-cenușiu..

Sulfura de zinc este insolubilă în apă. Poate provoca daune mediului, deoarece pătrunde în sol și contaminează apa subterană și curenții săi.
Sulfura de zinc poate fi produsă, printre alte reacții, prin coroziune și prin neutralizare.
Prin coroziune:
Zn + HDouăS => ZnS + HDouă
Prin neutralizare:
HDouăS + Zn (OH)Două => ZnS + 2HDouăSAU
Sulfura de zinc este o sare fosforescentă, care îi conferă capacitatea pentru utilizări și aplicații multiple. În plus, este un semiconductor și un fotocatalizator.
Indice articol
- 1 Structură
- 1.1 Blend de zinc
- 1.2 Wurzita
- 2 Proprietăți
- 2.1 Culoare
- 2.2 Punctul de topire
- 2.3 Solubilitatea în apă
- 2.4 Solubilitate
- 2.5 Densitate
- 2.6 Duritatea
- 2.7 Stabilitate
- 2.8 Descompunerea
- 3 Nomenclatură
- 3.1 Nomenclaturile sistematice și tradiționale
- 4 utilizări
- 4.1 Ca pigmenți sau acoperiri
- 4.2 Datorită fosforescenței sale
- 4.3 Semiconductori, fotocatalizatori și catalizatori
- 5 Referințe
Structura
Sulfura de zinc adoptă structuri cristaline guvernate de atracții electrostatice între cationul ZnDouă+ iar anionul SDouă-. Acestea sunt două: sfalerită sau blendă de zinc și wurzită. În ambii, ionii minimizează repulsiile dintre ioni cu sarcini egale..
Blenda de zinc este cea mai stabilă în condițiile terestre de presiune și temperatură; iar wurzita, care este mai puțin densă, rezultă din rearanjarea cristalină din cauza temperaturii crescute.
Cele două structuri pot coexista în același solid ZnS în același timp, deși, foarte încet, wurzita va ajunge să domine..
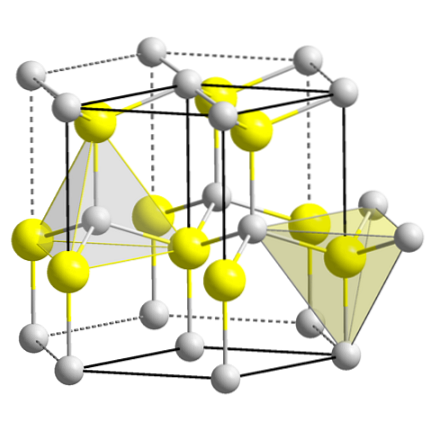
Zinc blende

Imaginea superioară arată celula unității cubice centrată pe fețele structurii blendei de zinc. Sferele galbene corespund anionilor SDouă-, iar cele gri la cationii ZnDouă+, situate la colțuri și în centrele fețelor cubului.
Observați geometriile tetraedrice din jurul ionilor. Blenda de zinc poate fi reprezentată și de aceste tetraedre, ale căror găuri din interiorul cristalului au aceeași geometrie (găuri tetraedrice).
La fel, în cadrul celulelor unitare, proporția ZnS este îndeplinită; adică un raport 1: 1. Astfel, pentru fiecare cation ZnDouă+ există un anion SDouă-. În imagine poate părea că sferele gri abundă, dar în realitate, deoarece se află în colțurile și centrul fețelor cubului, sunt împărțite de alte celule.
De exemplu, dacă luați cele patru sfere galbene care se află în interiorul cutiei, „bucățile” tuturor sferelor gri din jurul ei ar trebui să fie egale (și o fac) cu patru. Astfel, în celula unității cubice există patru ZnDouă+ și patru SDouă-, îndeplinind raportul stoichiometric ZnS.
De asemenea, este important să subliniem că există găuri tetraedrice în fața și în spatele sferelor galbene (spațiul care le separă unele de altele).
Wurzita
Spre deosebire de structura blendei de zinc, wurzita adoptă un sistem de cristal hexagonal (imaginea de sus). Acest lucru este mai puțin compact, astfel încât solidul are o densitate mai mică. Ionii din wurzite au, de asemenea, împrejurimi tetraedrice și un raport 1: 1 care este de acord cu formula ZnS..
Proprietăți
Culoare
Poate fi prezentat în trei moduri:
-Wurtzite, cu cristale albe și hexagonale.
-Sphalerita, cu cristale alb-cenușiu și cristale cubice.
-Ca o pulbere albă până la alb-cenușie sau gălbuie, și cristale gălbui cubice.
Punct de topire
1700º C.
Solubilitatea apei
Practic insolubil (0,00069 g / 100 ml la 18 ° C).
Solubilitate
Insolubil în alcalii, solubil în acizi minerali diluați.
Densitate
Sphalerite 4,04 g / cm3 și wurtzite 4,09 g / cm3.
Duritate
Are o duritate de 3 până la 4 pe scara Mohs.
Stabilitate
Când conține apă, se oxidează încet până la sulfat. Într-un mediu uscat este stabil.
Descompunere
Când este încălzit la temperaturi ridicate, acesta emite vapori toxici de zinc și oxizi de sulf.
Nomenclatură
Configurația electronică a Zn este [Ar] 3d104sDouă. Prin pierderea celor doi electroni ai orbitalului 4s rămâne ca cationul ZnDouă+ cu orbitalele lor umplute. Prin urmare, din moment ce electronic ZnDouă+ este mult mai stabil decât Zn+, are doar o valență de +2.
Prin urmare, este omis pentru nomenclatura stoc, adăugându-și valența inclusă între paranteze și cu cifre romane: sulfură de zinc (II).
Nomenclaturi sistematice și tradiționale
Dar există și alte modalități de a apela ZnS pe lângă cel deja ridicat. În sistematică, numărul atomilor fiecărui element este specificat cu numeratorii greci; cu singura excepție a elementului din dreapta atunci când este doar unul. Astfel, ZnS este denumit astfel: maimuţăsulfură de zinc (și nu monosulfură de monozinc).
În ceea ce privește nomenclatura tradițională, zincul având o singură valență de +2 se adaugă prin adăugarea sufixului -ico. În consecință, denumirea sa tradițională rezultă: sulfură de zincico.
Aplicații
Ca pigmenți sau acoperiri
-Sachtolith este un pigment alb realizat cu sulfură de zinc. Se utilizează în cofrete, mastici, etanșanți, pardoseli, vopsele de latex și semnalizare.
Utilizarea acestuia în combinație cu pigmenți absorbanți ai luminii ultraviolete, cum ar fi pigmenți micro-titanici sau oxizi de fier transparenți, este necesară în pigmenții rezistenți la intemperii.
-Când ZnS este aplicat pe latex sau vopsele texturate are o acțiune microbicidă prelungită.
-Datorită durității sale mari și rezistenței la rupere, eroziune, ploaie sau praf, îl face potrivit pentru ferestrele cu infraroșu exterior sau în cadrul aeronavei..
-ZnS este utilizat în acoperirea rotoarelor utilizate în transportul compușilor, pentru a reduce uzura. Este, de asemenea, utilizat la producerea cernelurilor de tipărire, a compușilor izolați, a pigmentării termoplastice, a materialelor plastice rezistente la flacără și a lămpilor electroluminescente..
-Sulfura de zinc poate fi transparentă și poate fi utilizată ca fereastră pentru optica vizibilă și optica în infraroșu. Utilizat în dispozitive de vizionare nocturnă, ecrane de televiziune, ecrane radar și acoperiri fluorescente.
-ZnS cu dopaj Cu este utilizat în producția de panouri de electroluminiscență. De asemenea, este utilizat în propulsia rachetelor și gravimetria.
Pentru fosforescența sa
-Fosforescența sa este utilizată pentru a nuanța acele ceasurilor și astfel a afișa ora în întuneric; de asemenea, în vopsea pentru jucării, în semne de urgență și avertismente de trafic.
Fosforescența permite utilizarea sulfurii de zinc în tuburile catodice și ecranele cu raze X pentru a străluci în pete întunecate. Culoarea fosforescenței depinde de activatorul utilizat.
Semiconductor, fotocatalizator și catalizator
-Sphalerita și wurtzita sunt semiconductori cu bandă largă. Sphalerita are o despicătură de bandă de 3,54 eV, în timp ce wurtzita are o despicătură de bandă de 3,91 eV.
-ZnS este utilizat la prepararea unui fotocatalizator compus din CdS - ZnS / zirconiu - fosfat de titan utilizat pentru producerea de hidrogen sub lumină vizibilă.
-Acționează ca un catalizator pentru degradarea poluanților organici. Folosit la prepararea unui sincronizator de culoare în lămpile cu LED-uri.
-Nanocristalele sale sunt utilizate pentru detectarea proteinei ultrasensibile. De exemplu, prin emiterea de lumină din punctele cuantice ale ZnS. Se utilizează la prepararea unui fotocatalizator combinat (CdS / ZnS) -TiO2 pentru producția electrică prin fotoelectrocataliză.
Referințe
- PubChem. (2018). Sulfură de zinc. Luat de la: pubchem.ncbi.nlm.nih.gov
- QuimiNet. (2015, 16 ianuarie). Pigment alb pe bază de sulfură de zinc. Recuperat de pe: quiminet.com
- Wikipedia. (2018). Sulfură de zinc. Luat de pe: en.wikipedia.org
- II-VI UK. (2015). Sulfură de zinc (ZnS). Luat din: ii-vi.es
- Rob Toreki. (2015, 30 martie). Structura Zincblende (ZnS). Preluat de pe: ilpi.com
- Chimie LibreTexte. (22 ianuarie 2017). Structură-Zinc Blende (ZnS). Preluat de pe: chem.libretexts.org
- Reade. (2018). Sulfură de zinc / sulfură de zinc (ZnS). Luat de pe: reade.com

Nimeni nu a comentat acest articol încă.