
Structura tetraclorurii de carbon (CCl4), proprietăți, utilizări
tetraclorură de carbon este un lichid incolor, cu un miros ușor dulce, asemănător cu mirosul de eter și cloroform. Formula sa chimică este CCl4, și constituie un compus covalent și volatil, al cărui vapor este de densitate mai mare decât aerul; nu este un conductor de electricitate și nici nu este inflamabil.
Se găsește în atmosferă, apă de râu, mare și sedimente de pe suprafața marină. Se crede că tetraclorura de carbon prezentă în algele roșii este sintetizată de același organism.
În atmosferă este produs de reacția clorului și metanului. Tetraclorura de carbon produsă industrial pătrunde în ocean, în principal prin interfața mare-aer. Fluxul său atmosferic => oceanic a fost estimat la 1,4 x 1010 g / an, echivalent cu 30% din totalul tetraclorurii de carbon din atmosferă.
Indice articol
- 1 Caracteristici principale
- 2 Structura
- 3 Proprietăți fizice și chimice
- 4 utilizări
- 4.1 Fabricarea produselor chimice
- 4.2 Fabricarea agentilor frigorifici
- 4.3 Suprimarea incendiilor
- 4.4 Curățarea
- 4.5 Analiza chimică
- 4.6 Spectroscopie în infraroșu și rezonanță magnetică nucleară
- 4.7 Solvent
- 4.8 Alte utilizări
- 5 Toxicitate
- 5.1 Mecanisme hepatotoxice
- 5.2 Efecte toxice asupra sistemului nervos central și renal
- 5.3 Efectele expunerii la om
- 5.4 Interacțiuni toxice
- 6 Interacțiuni intermoleculare
- 7 Referințe
Caracteristici principale
Tetraclorura de carbon este produsă industrial prin clorurarea termică a metanului, reacționând metanul cu clor gazos la o temperatură cuprinsă între 400 ° C și 430 ° C. În timpul reacției este generat un produs brut, cu un subprodus de acid clorhidric.
De asemenea, este produs industrial prin metoda disulfurii de carbon. Clorul și disulfura de carbon reacționează la o temperatură cuprinsă între 90 ° C și 100 ° C, folosind fierul ca catalizator. Apoi, produsul brut este supus fracționării, neutralizării și distilării.
CCl4 A avut multiple utilizări, printre altele: solvent pentru grăsimi, uleiuri, lacuri etc; curățarea uscată a hainelor; fumigarea pesticidelor, agriculturii și fungicidelor și fabricarea nailonului. Cu toate acestea, în ciuda utilității sale mari, utilizarea sa a fost parțial aruncată din cauza toxicității ridicate pe care o prezintă..
La om generează efecte toxice asupra pielii, ochilor și căilor respiratorii. Dar efectele sale cele mai dăunătoare apar asupra funcționării sistemului nervos central, a ficatului și a rinichilor. Afectarea rinichilor este probabil principala cauză de decese atribuite acțiunii toxice a tetraclorurii de carbon.
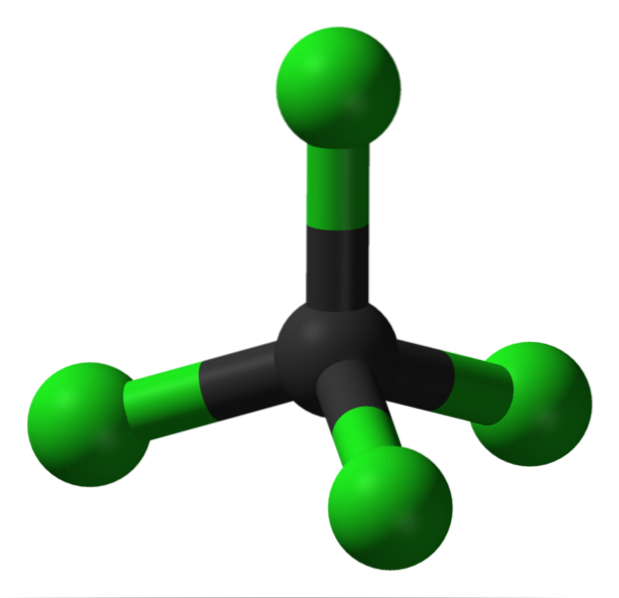
Structura
În imagine puteți vedea structura tetraclorurii de carbon, care are o geometrie tetraedrică. Rețineți că atomii Cl (sferele verzi) sunt orientați în spațiul din jurul carbonului (sferă neagră) desenând un tetraedru.
De asemenea, trebuie menționat faptul că, deoarece toate vârfurile tetraedrului sunt identice, structura este simetrică; adică, indiferent de modul în care este rotită molecula CCl4, va fi întotdeauna la fel. Deci, din moment ce tetraedrul verde al CCl4 este simetric, rezultă în absența unui moment dipolar permanent.
De ce? Pentru că, deși legăturile C-Cl au un caracter polar datorită electronegativității mai mari a Cl față de C, aceste momente se anulează vectorial. Prin urmare, este un compus organic clorurat apolar..
Carbonul este complet clorurat în CCl4, care este egal cu oxidarea ridicată (carbonul poate forma maximum patru legături cu clorul). Acest solvent nu tinde să piardă electroni, este aprotic (nu are hidrogen) și reprezintă un mijloc mic de transport și stocare a clorului..
Proprietati fizice si chimice
Formulă
CCl4
Greutate moleculară
153,81 g / mol.
Aspectul fizic
Este un lichid incolor. Se cristalizează sub formă de cristale monoclinice.
Miros
Are mirosul caracteristic prezent în alți solvenți clorurați. Mirosul este aromat și oarecum dulce, similar cu mirosul de tetracloretilenă și cloroform.
Punct de fierbere
170,1ºF (76,8ºC) la 760mmHg.
Punct de topire
-9ºF (-23ºC).
Solubilitatea apei
Este slab solubil în apă: 1,16 mg / ml la 25 ºC și 0,8 mg / ml la 20 ºC. De ce? Deoarece apa, o moleculă extrem de polară, nu „simte” afinitate pentru tetraclorura de carbon, care este nepolară..
Solubilitate în solvenți organici
Datorită simetriei structurii sale moleculare, tetraclorura de carbon este un compus nepolar. Prin urmare, este miscibil cu alcool, benzen, cloroform, eter, disulfură de carbon, eter de petrol și nafta. De asemenea, este solubil în etanol și acetonă..
Densitate
În stare lichidă: 1,59 g / ml la 68 ° F și 1,594 g / ml la 20 ° C.
În stare solidă: 1,831 g / ml la -186 ºC și 1,809 g / ml la -80 ºC.
Stabilitate
În general inert.
Acțiune corozivă
Atacă unele forme de materiale plastice, cauciucuri și acoperiri.
punctul de aprindere
Este considerat ca fiind puțin inflamabil, indicând punctul de aprindere sub 982 ° C.
Aprindere automată
982 ºC (1800 º F; 1255 K).
Densitatea vaporilor
5.32 în raport cu aerul, luată ca valoare de referință egală cu 1.
Presiunea de vapori
91 mmHg la 68 ° F; 113 mmHg la 77 ° F și 115 mmHg la 25 ° C.
Descompunere
În prezența focului, formează clorură și fosgen, un compus foarte toxic. De asemenea, în aceleași condiții se descompune în clorură de hidrogen și monoxid de carbon. În prezența apei la temperaturi ridicate, poate provoca acid clorhidric.
Viscozitate
2,03 x 10-3 Pa s
Pragul mirosului
21,4 ppm.
Indicele de refracție (ηD)
1.4607.
Aplicații
Fabricarea produselor chimice
-Acesta intervine ca agent de clorurare și / sau solvent în fabricarea clorului organic. La fel, intervine ca monomer în fabricarea nailonului..
-Acționează ca solvent în fabricarea cimentului de cauciuc, a săpunului și a insecticidului.
-Este utilizat la fabricarea clorofluorocarbonului propulsor.
-Deoarece nu are legături C-H, tetraclorura de carbon nu suferă reacții de radicali liberi, făcându-l un solvent util pentru halogenări, fie de un halogen elementar, fie de un reactiv de halogenare, cum ar fi N-bromosuccinimida..
Fabricarea agentului frigorific
A fost utilizat în producția de clorofluorocarbon, agent frigorific R-11 și triclorofluormetan, agent frigorific R-12. Acești agenți frigorifici distrug stratul de ozon, motiv pentru care s-a recomandat încetarea utilizării lor, în conformitate cu recomandările Protocolului de la Montreal..
Suprimarea focului
La începutul secolului al XX-lea, tetraclorura de carbon a început să fie folosită ca stingător, pe baza unui set de proprietăți ale compusului: este volatil; vaporii săi sunt mai grei decât aerul; nu este un conductor electric și nu este foarte inflamabil.
Când tetraclorura de carbon este încălzită, aceasta se transformă într-un vapor greu care acoperă produsele de ardere, izolându-le de oxigenul prezent în aer și provocând stingerea focului. Este potrivit pentru combaterea incendiilor cu ulei și aparate.
Cu toate acestea, la temperaturi mai mari de 500 ° C, tetraclorura de carbon poate reacționa cu apa, provocând fosgen, un compus toxic, de aceea trebuie acordată atenție ventilației în timpul utilizării. În plus, poate reacționa exploziv cu sodiu metalic și ar trebui evitată utilizarea acestuia în incendii cu prezența acestui metal..
Curățare
Tetraclorura de carbon a fost folosită de mult timp la curățarea uscată a hainelor și a altor materiale de uz casnic. În plus, este folosit ca degresant industrial pentru metale, excelent pentru dizolvarea grăsimilor și a uleiului.
Analiza chimica
Folosit pentru detectarea borului, bromurii, clorurii, molibdenului, tungstenului, vanadiului, fosforului și argintului.
Spectroscopie în infraroșu și rezonanță magnetică nucleară
-Este utilizat ca solvent în spectroscopie în infraroșu, deoarece tetraclorura de carbon nu are o absorbție semnificativă în benzi> 1600 cm-1.
-A fost folosit ca solvent în rezonanța magnetică nucleară, deoarece nu a interferat cu tehnica, deoarece nu avea hidrogen (este aprotic). Dar, datorită toxicității sale și a puterii sale reduse de solvent, tetraclorura de carbon a fost înlocuită cu solvenți deuterizați..
Solvent
Caracteristica de a fi un compus nepolar permite utilizarea tetraclorurii de carbon ca agent de dizolvare pentru uleiuri, grăsimi, lacuri, lacuri, ceruri de rășină și rășini. De asemenea, poate dizolva iodul.
Alte utilizări
-Este o componentă importantă în lămpile de lavă, deoarece tetraclorura de carbon adaugă greutate cerii datorită densității sale..
-Folosit de colecționarii de timbre, deoarece dezvăluie filigranele pe timbre fără a provoca daune.
-A fost folosit ca agent pesticid și fungicid și în fumigarea boabelor pentru a elimina insectele.
-În procesul de tăiere a metalului este utilizat ca lubrifiant.
-A fost utilizat în medicina veterinară ca antihelmintic în tratamentul fasciolazei, cauzată de Fasciola hepatica la ovine..
Toxicitate
-Tetraclorura de carbon poate fi absorbită pe căile respiratorii, digestive, oculare și cutanate. Ingerarea și inhalarea sunt foarte periculoase, deoarece pot provoca leziuni severe pe termen lung la creier, ficat și rinichi..
-Contactul cu pielea provoacă iritații și pe termen lung poate provoca dermatită. În timp ce contactul cu ochii provoacă iritații.
Mecanisme hepatotoxice
Principalele mecanisme care produc leziuni hepatice sunt stresul oxidativ și alterarea homeostaziei calciului.
Stresul oxidativ este un dezechilibru între producția de specii reactive de oxigen și capacitatea organismului de a genera un mediu reducător, în celulele sale, care controlează procesele oxidative..
Dezechilibrul în starea redox normală poate provoca efecte toxice datorate producției de peroxizi și a radicalilor liberi care deteriorează toate componentele celulelor..
Tetraclorura de carbon este metabolizată producând radicali liberi: Cl3C. (radical triclorometil) și Cl3GÂNGURI. (radical peroxid de triclorometil). Acești radicali liberi produc lipoperoxidare, care provoacă daune ficatului și, de asemenea, plămânului.
Radicalii liberi provoacă, de asemenea, ruperea membranei plasmatice a celulelor hepatice. Aceasta produce o creștere a concentrației de calciu citosolic și o scădere a mecanismului intracelular de sechestrare a calciului..
Creșterea calciului intracelular activează enzima fosfolipază ADouă care acționează asupra fosfolipidelor membranei, agravând afectarea acesteia. În plus, există infiltrare de neutrofile și leziuni hepatocelulare. Există o scădere a concentrației celulare de ATP și glutation care determină inactivarea enzimei și moartea celulară.
Efecte toxice asupra sistemului renal și asupra sistemului nervos central
Efectele toxice ale tetraclorurii de carbon se manifestă în sistemul renal cu o scădere a producției de urină și a acumulării de apă din corp. Mai ales în plămâni și o creștere a concentrației deșeurilor metabolice din sânge. Acest lucru poate provoca moartea.
La nivelul sistemului nervos central, există implicarea conducerii axonale a impulsurilor nervoase.
Efectele expunerii la om
Durata scurta
Iritatie la ochi; efecte asupra ficatului, rinichilor și sistemului nervos central, care pot duce la pierderea cunoștinței.
Durata lunga
Dermatită și posibilă acțiune cancerigenă.
Interacțiuni toxice
Există o asociere între multe dintre cazurile de otrăvire cu tetraclorură de carbon și consumul de alcool. Consumul excesiv de alcool provoacă leziuni hepatice, în unele cazuri provocând ciroză hepatică.
S-a observat că toxicitatea tetraclorurii de carbon crește cu barbiturice, deoarece acestea au unele efecte toxice similare..
De exemplu, la nivel renal, barbituricele reduc excreția de urină, această acțiune a barbituricelor fiind similară cu efectul toxic al tetraclorurii de carbon asupra funcției renale..
Interacțiuni intermoleculare
CCl4 poate fi considerat ca un tetraedru verde. Cum interacționați cu ceilalți?
Fiind o moleculă apolară, fără moment dipol permanent, nu poate interacționa prin forțe dipol-dipol. Pentru a-și menține moleculele împreună în lichid, atomii de clor (vârfurile tetraedrului) trebuie să interacționeze între ei într-un fel; și o fac datorită forțelor de dispersie din Londra.
Norii electronici ai atomilor de Cl se mișcă și, pentru scurte momente, generează zone bogate și sărace de electroni; adică generează dipoli instantanei.
Zona bogată în electroni δ determină polarizarea atomului de Cl al unei molecule vecine: Clδ- δ+Cl. Astfel, doi atomi de Cl pot fi ținuți împreună pentru o perioadă limitată..
Dar, deoarece există milioane de molecule CCl4, interacțiunile devin suficient de eficiente pentru a forma un lichid în condiții normale.
Mai mult, cele patru CI legate covalent la fiecare C cresc considerabil numărul acestor interacțiuni; atât de mult încât fierbe la 76,8ºC, un punct de fierbere ridicat.
Punctul de fierbere al CCl4 nu poate fi mai mare deoarece tetraedrele sunt relativ mici în comparație cu alți compuși apolari (cum ar fi xilenul, care fierbe la 144 ° C).
Referințe
- Hardinger A. Steven. (2017). Glosar ilustrat de chimie organică: tetraclorură de carbon. Recuperat de la: chem.ucla.edu
- Toate Siyavula. (s.f.). Forțele intermoleculare și interatomice. Recuperat de pe: siyavula.com
- Carey F. A. (2006). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Wikipedia. (2018). Tetraclorură de carbon. Recuperat de pe: en.wikipedia.org
- PubChem. (2018). Tetraclorură de carbon. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Carte chimică. (2017). Tetraclorură de carbon. Recuperat de pe: chemicalbook.com



Nimeni nu a comentat acest articol încă.