
Structura uracilului, funcții, proprietăți, sinteză
uracil Este o bază azotată de tip pirimidină, găsită în acidul ribonucleic (ARN). Aceasta este una dintre caracteristicile care diferențiază ARN de acidul dezoxiribonucleic (ADN), deoarece acesta din urmă are timină în loc de uracil. Ambele substanțe, uracil și timină, diferă doar prin faptul că a doua are o grupare metil.
Din punct de vedere evolutiv, s-a propus că ARN-ul a fost prima moleculă care a stocat informații genetice și a funcționat ca un catalizator în celule, înainte de ADN și enzime. Din această cauză, se crede că uracilul a jucat un rol cheie în evoluția vieții.
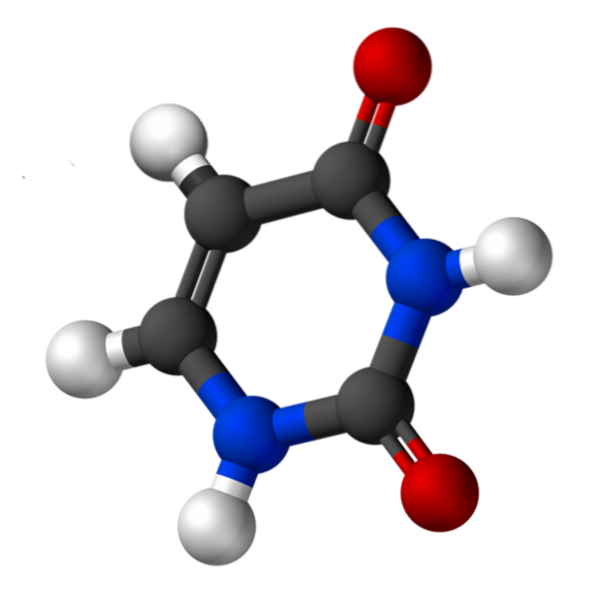
La ființele vii, uracilul nu se găsește într-o formă liberă, dar formează în mod obișnuit nucleotide monofosfat (UMP), difosfat (UDP) și trifosfat (UTP). Aceste nucleotide uracil au funcții diferite, cum ar fi ARN și biosinteza glicogenului, interconversia izomerică a zaharurilor și reglarea glutaminei sintază..
Indice articol
- 1 Structură și proprietăți
- 2 Biosinteza
- 2.1 Reglarea biosintezei
- 3 Rolul în biosinteza ARN
- 4 Rolul în biosinteza zahărului
- 5 Rol în interconversia izomerică a zaharurilor
- 6 Rolul în biosinteza glicoproteinelor
- 7 Rol în reglarea glutaminei sintază
- 8 Rol în editarea ARN
- 9 Biosinteza UDP-glucozei
- 10 Uracil ADN glicozilaza
- 11 Referințe
Structură și proprietăți
Uracil, numit 2,4-dioxipiridină, are formula empirică C4H4NDouăSAUDouă, a cărei greutate moleculară este de 112,09 g / mol și este purificată sub formă de pulbere albă.
Structura uridinei este un inel heterociclic cu patru atomi de carbon și doi atomi de azot, cu legături duble alternante. Este planar.
Are o solubilitate de 50 mg / ml, la 25 ° C, în hidroxid de sodiu 1M și un pKa între 7,9 și 8,2. Lungimea de undă unde are loc absorbția sa maximă (ʎmax) este între 258 și 260 nm.
Biosinteza
Există o cale comună pentru biosinteza nucleotidelor pirimidinice (uracil și citokină). Primul pas este biosinteza carbamoil fosfatului din CODouă și NH4+, care este catalizată de carbamoil fosfat sintetaza.
Pirimidina este construită din carboiil fosfat și aspartat. Ambele substanțe reacționează și formează N-carbamoilpartat, o reacție catalizată de aspartat transcabamoilază (ATCază). Închiderea inelului pirimidinic este cauzată de deshidratarea catalizată de dihidrootază și produce L-dihidrotorat..
L-dihidrorotatul este oxidat și transformat în orotat; acceptorul de electroni este NAD+. Este o reacție catalizată de dihidroorotat dehidrogenază. Următorul pas este transferul grupării fosforibozil, de la fosforibosil pirofosfat (PRPP), la orotare. Formează orotidilat (OMP) și pirofosfat anorganic (PPi), catalizat de orotat fosforibozil transferază.
Ultima etapă constă în decarboxilarea inelului pirimidinic al orotidilatului (OMP). Formează uridilat (uridină-5'-monofosfat, UMP), care este catalizat de o decarboxilază.
Apoi, prin participarea unei kinaze, o grupare fosfat este transferată de la ATP la UMP, formând UDP (uridină-5'-difosfat). Acesta din urmă se repetă, formând UTP (uridin-5'-trifosfat).
Reglarea biosintezei
La bacterii, reglarea biosintezei pirimidinei are loc prin feedback negativ, la nivelul aspartatului transcabamoilazei (ATCază).
Această enzimă este inhibată de CTP (citidină-5'-trifosfat), care este produsul final al căii biosintetice a pirimidinei. ATCase are subunități de reglementare care se leagă de regulatorul alosteric CTP.
La animale, reglarea biosintezei pirimidinei are loc prin feedback negativ, la nivelul a două enzime: 1) carbamoil fosfat sintază II, care este inhibat de UTP și activat de ATP și PRPP; și 2) OMP decarboxilaza, care este inhibată de produsul reacției pe care o catalizează, UMP. Rata de biosinteză a OMP variază în funcție de disponibilitatea PRPP.
Rolul în biosinteza ARN
Uracil este prezent în toate tipurile de ARN, cum ar fi ARN mesager (ARNm), ARN de transfer (ARNt) și ARN ribozomal (ARNr). Biosinteza acestor molecule are loc printr-un proces numit transcripție..
În timpul transcrierii, informațiile conținute în ADN sunt copiate în ARN de o ARN polimerază. Procesul invers, în care informațiile conținute în ARN sunt copiate în ADN, are loc la unele viruși și plante prin transcriptază inversă..
Biosinteza ARN necesită trifosfat nucleozidic (NTP) și anume: trifosfat de uridină (UTP), trifosfat de citidină (CTP), trifosfat de adenină (ATP) și trifosfat de guanină (GTP). Reacția este:
(ARN)n reziduuri + NTP -> (ARN)n + 1 reziduu + PPi
Hidroliza pirofosfatului anorganic (PPi) furnizează energia pentru biosinteza ARN.
Rolul în biosinteza zahărului
Esterii zahărului sunt foarte frecvenți în organismele vii. Unii dintre acești esteri sunt difosfați esterici nucleozidici, cum ar fi zaharurile UDP, care sunt foarte abundente în celule. Zaharurile UDP participă la biosinteza dizaharidelor, oligozaharidelor și polizaharidelor.
La plante, biosinteza zaharozei are loc prin două căi: una primară și una secundară.
Calea principală este transferul de D-glucoză din UDP-D-glucoză în D-fructoză pentru a forma zaharoză și UDP. Calea secundară include două etape: începe cu UDP-D-glucoză și fructoză-6-fosfat și se termină cu formarea zaharozei și fosfatului..
În glandele mamare, biosinteza lactozei apare din UDP-D-galactoză și glucoză.
La plante, biosinteza celulozei se realizează prin condensarea continuă a reziduurilor de beta-D-glucozil, de la UDP-glucoză până la capătul nereducător al lanțului de poliglucoză în creștere. În mod similar, biosinteza amilozei și amilopectinei necesită UDP-glucoză ca substrat donator de glucoză pentru lanțul în creștere..
La animale, atât UDP-glucoza, cât și ADP-glucoza sunt utilizate pentru biosinteza glicogenului. În mod similar, biosinteza sulfatului de condroitină necesită UDP-xiloză, UDP-galactoză și UDP-glucuronat..
Rol în interconversia izomerică a zaharurilor
Conversia galactozei într-un intermediar de glicoliză are loc prin calea Leloir. Unul dintre pașii acestei căi este catalizat de enzima UDP-galactoză-4-epimerază, care facilitează interconversia UDP-galactoză în UDP-glucoză..
Rolul în biosinteza glicoproteinelor
În timpul biosintezei glicoproteinelor, proteinele traversează sacii cis, mijlocii și trans ai aparatului Golgi.
Fiecare dintre aceste saci are un set de enzime care procesează glicoproteinele. Monomerii zahărului, cum ar fi glucoza și galactoza, sunt adăugați la proteina oligozaharidă din UDP-hexoză și alte nucleotide-hexoză.
Nucleotidele de hexoză sunt transportate la cisternele Golgi de către antiport. UDP-galactoză (UDP-Gal) și UDP-N-acetilgalactozamină (UDP-GalNAc) intră în cisterna din citosol prin schimb cu UMP.
În cisterna Golgi, o fosfatază hidrolizează o grupare fosfat pe UDP și formează UMP și Pi. UDP provine din reacțiile catalizate de galactoziltransferază și N-acetilgalactosamiltransferază. UMP format din fosfatază servește la schimbul nucleotidă-hexoză.
Rol în reglarea glutaminei sintază
Un mecanism de reglare al glutaminei sintază este modificarea covalentă, care constă în adenilare, care o inactivează, și dedenilare, care o activează. Această modificare covalentă este reversibilă și catalizată de adeniltransferază..
Activitatea adeniltransferazei este modulată de legarea proteinei PII, care este reglată printr-o modificare covalentă, uridinilarea.
Atât uridilarea, cât și deuridilarea sunt efectuate de uridililtransferază. În această enzimă, activitatea de uridilare se datorează glutaminei și fosfatului și este activată prin legarea alfa-cetoglutaratului și a ATP de PII..
Rol în editarea ARN
Unele ARNm sunt editate înainte de traducere. În unele organisme eucariote, cum ar fi Trypanosoma brucei, există editarea ARN a transcriptului genei citocrom oxidazei subunității II. Acest lucru se întâmplă prin inserarea reziduurilor de uracil, o reacție catalizată de uridiltransferaza terminală..
Un ARN ghid, complementar produsului editat, acționează ca un șablon pentru procesul de editare. Perechile de baze formate între transcrierea inițială și ARN-ul de ghidare implică perechi de baze G = U care nu sunt Watson-Crick și sunt comune în ARN..
UDP-biosinteza glucozei
În condiții fiziologice, biosinteza glicogenului din glucoză-1-fosfat este imposibilă termodinamic (positiveG pozitiv). Datorită acestui fapt, înainte de biosinteză, are loc activarea glucozei-1-fosfat (G1P). Această reacție combină G1P și UTP pentru a forma uridină difosfat glucoză (UDP-glucoză sau UDPG)..
Reacția este catalizată de UDP-glucoză pirofosforilază și este după cum urmează:
G1P + UTP -> UDP-glucoză + 2Pi.
Variația de energie liberă Gibbs în acest pas este mare și negativă (-33,5 KJ / mol). În timpul reacției la oxigen, G1P atacă atomul de fosfat alfa al UTP și formează UDP-glucoză și pirofosfat anorganic (PPi). Apoi, PPi este hidrolizat de o pirofosfatază anorganică, a cărei energie de hidroliză este cea care determină reacția generală.
UDP-glucoza este o substanță cu „mare energie”. Permite formarea legăturilor glicozidice între reziduul de glucoză și lanțul de polizaharide în creștere. Același principiu energetic se aplică reacțiilor la care participă zaharurile UDP, cum ar fi biosinteza dizaharidelor, oligozaharidelor și glicoproteinelor..
Uracil ADN glicozilaza
Există leziuni ADN care apar spontan. Una dintre aceste leziuni este dezaminarea spontană a citokinei și conversia acesteia în uracil. În acest caz, repararea are loc prin îndepărtarea bazei ADN modificate de către o enzimă numită uracil ADN glicozilază..
Enzima uracil ADN glicozilaza îndepărtează citokina deteriorată (uracil), producând un reziduu de deoxiriboză care nu are baza de azot, numit situs AP (situs apurinic-pirimidinic).
Endonucleaza enzimei AP taie apoi coloana vertebrală a fosfodiesterului situsului AP, îndepărtând reziduul de zahăr-fosfat. ADN polimeraza I restabilește catena deteriorată.
Referințe
- Bohinski, R. 1991. Biochimie. Addison-Wesley Iberoamericana, Wilmington, Delaware.
- Devlin, T.M. 2000. Biochimie. Editorial Reverté, Barcelona.
- Lodish, H., Berk, A., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Biologie celulară și moleculară. Editorial Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexic, São Paulo.
- Nelson, D. L., Cox, M. M. 2008. Lehninger-Principiile biochimiei. W.H. Freeman, New York.
- Voet, D. și Voet, J. 2004. Biochimie. John Wiley and Sons, SUA.

Nimeni nu a comentat acest articol încă.