
Istoricul iodului, proprietăți, structură, obținere, riscuri, utilizări
iod Este un element nemetalic reactiv care aparține grupului 17 al tabelului periodic (halogeni) și este reprezentat de simbolul chimic I. În esență, este un element destul de popular, de la apa iodată la hormonul tirozină..
În stare solidă, iodul este de culoare gri închis, cu un luciu metalic (imaginea inferioară), capabil să se sublimeze pentru a produce vapori violet care, condensat pe o suprafață rece, lasă un reziduu întunecat. Numeroase și atractive au fost experimentele pentru a demonstra aceste caracteristici.

Acest element a fost izolat pentru prima dată de Bernard Curtois în anul 1811, obținând în același timp compuși care au servit ca materie primă pentru fabricarea salpetrului. Cu toate acestea, Curtois nu a identificat iodul ca element, un merit împărtășit de Joseph Gay-Lussac și Humphry Davy. Gay-Lussac a identificat elementul ca „iode”, termen care provine din cuvântul grecesc „ioides” cu care a fost desemnată culoarea violet..
Iodul elementar, ca și ceilalți halogeni, este o moleculă diatomică, formată din doi atomi de iod legați printr-o legătură covalentă. Interacțiunea Van der Waals între moleculele de iod este cea mai puternică dintre halogeni. Aceasta explică de ce iodul este halogenul cu cele mai ridicate puncte de topire și fierbere. În plus, este cel mai puțin reactiv dintre halogeni și cel cu cea mai mică electronegativitate..
Iodul este un element esențial care trebuie ingerat, deoarece este necesar pentru creșterea corpului; dezvoltarea creierului și a mentalului; metabolismul în general etc., recomandând un aport zilnic de 110 µg / zi.
Deficitul de iod în starea fetală a unei persoane este asociat cu apariția cretinismului, o afecțiune caracterizată prin încetinirea creșterii corpului; precum și o dezvoltare mentală și intelectuală insuficientă, strabism etc..
Între timp, un deficit de iod la orice vârstă a individului este asociat cu apariția unui guș, caracterizat printr-o hipertrofie a tiroidei. Gușa este o boală endemică, deoarece este limitată la anumite zone geografice cu caracteristici nutritive proprii.
Indice articol
- 1 Istorie
- 1.1 Descoperire
- 1.2 Apariția numelui
- 1.3 Utilizări istorice
- 2 Proprietăți fizice și chimice
- 2.1 Aspect
- 2.2 Greutatea atomică standard
- 2.3 Număr atomic (Z)
- 2.4 Punct de topire
- 2.5 Punctul de fierbere
- 2.6 Densitate
- 2.7 Solubilitate
- 2.8 Miros
- 2.9 Coeficientul de partiție octanol / apă
- 2.10 Descompunerea
- 2.11 Vâscozitatea
- 2.12 Punct triplu
- 2.13 Punct critic
- 2.14 Căldura de fuziune
- 2.15 Căldura de vaporizare
- 2.16 Capacitate termică molară
- 2.17 Presiunea vaporilor
- 2.18 numere de oxidare
- 2.19 Electronegativitate
- 2.20 Energia de ionizare
- 2.21 Conductivitate termică
- 2.22 Rezistivitate electrică
- 2.23 Ordinea magnetică
- 2.24 Reactivitate
- 3 Structură și configurație electronică
- 3.1 - Atomul de iod și legăturile acestuia
- 3.2 - Cristale
- 3.3 - Faze
- 4 Unde se găsește și se obține
- 4.1 Caliciul
- 4.2 Saramura
- 5 Rolul biologic
- 5.1 - Dieta recomandată
- 5.2 - Hormoni tiroidieni
- 5.3 - Deficiență
- 6 Riscuri
- 7 utilizări
- 7.1 Medici
- 7.2 Reacții și acțiune catalitică
- 7.3 Fotografie și optică
- 7.4 Alte utilizări
- 8 Referințe
Poveste
Descoperire
Iodul a fost descoperit de chimistul francez Bernard Curtois, în anul 1811, în timp ce lucra cu tatăl său la producerea de săpun, necesitând carbonat de sodiu pentru aceasta..
Acest compus a fost izolat din alge marine pe care le-au colectat în largul coastelor Normandiei și Bretaniei. În acest scop, algele au fost arse și cenușa a fost spălată cu apă, distrugând reziduurile rezultate cu adăugarea de acid sulfuric..
Cu o ocazie, poate printr-o greșeală fortuită, Curtois a adăugat un exces de acid sulfuric și s-a format un vapor purpuriu care a cristalizat pe suprafețele reci, așezându-se ca cristale întunecate. Curtois bănuia că se află în prezența unui element nou și îl numea „Substanță X”.
Curtois a descoperit că această substanță, amestecată cu amoniac, formează un solid maro (triiodură de azot) care a explodat la cel mai mic contact.
Cu toate acestea, Curtois a avut limitări pentru a-și continua cercetările și a decis să dea mostre din substanța sa lui Charles Desormes, Nicolas Clément, Joseph Gay-Lussac și André-Marie Ampère, pentru a obține colaborarea lor..
Apariția numelui
În noiembrie 1813, Desormes și Clément au făcut publică descoperirea lui Curtois. În decembrie a aceluiași an, Gay-Lussac a subliniat că noua substanță ar putea fi un element nou, sugerând numele „iode” din cuvântul grecesc „ioides”, desemnat pentru violet..
Sir Humphry Davy, care a primit o porțiune din eșantionul dat Ampère de Curtois, a experimentat cu eșantionul și a observat o similaritate cu clorul. În decembrie 1813, Societatea Regală din Londra a fost implicată în identificarea unui nou element.
Deși a apărut o discuție între Gay-Lussac și Davy despre identificarea iodului, amândoi au recunoscut că Curtois a fost primul care l-a izolat. În 1839 Curtois a primit în cele din urmă Premiul Montyn de la Academia Regală de Științe ca recunoaștere a izolării iodului..
Utilizări istorice
În 1839, Louis Daguerre a dat iodului prima sa utilizare comercială, inventând o metodă de producere a imaginilor fotografice numite daguerreotipuri, pe foi subțiri de metal..
În 1905, patologul american David Marine, a investigat deficiența de iod în anumite boli și a recomandat aportul acestuia.
Proprietati fizice si chimice
Aspect

Gri închis solid, cu luciu metalic. Când este sublimat, vaporii săi sunt de culoare violet (imaginea de sus).
Greutatea atomică standard
126.904 u
Număr atomic (Z)
53
Punct de topire
113,7 ºC
Punct de fierbere
184,3 ºC
Densitate
Temperatura ambientală: 4.933 g / cm3
Solubilitate
Se dizolvă în apă pentru a produce soluții maro cu o concentrație de 0,03% la 20 ° C..
Această solubilitate este considerabil crescută dacă există ioni de iodură dizolvate anterior, deoarece se stabilește un echilibru între I- și euDouă pentru a forma specia anionică I3-, care solvatează mai bine decât iodul.
În solvenții organici precum cloroformul, tetraclorura de carbon și disulfura de carbon, iodul se dizolvă dând o nuanță violetă. De asemenea, se dizolvă în compuși azotați, cum ar fi piridina, chinolina și amoniacul, pentru a forma din nou o soluție maro..
Diferența dintre colorații constă în faptul că iodul este dizolvat ca molecule I solvatateDouă, sau ca complexe de transfer de marfă; aceștia din urmă apar atunci când sunt solvenți polari (apă printre ei), care se comportă ca bazele Lewis prin donarea de electroni la iod.
Miros
Înțepător, iritant și caracteristic. Pragul de miros: 90 mg / m3 și prag de miros iritant: 20 mg / m3.
Coeficientul de partiție octanol / apă
Jurnal P = 2,49
Descompunere
Când este încălzit până la descompunere, emite un fum de iodură de hidrogen și diferiți compuși ai iodurii..
Viscozitate
2,27 cP la 116 ºC
Punct triplu
386,65 K și 121 kPa
Punct critic
819 K și 11,7 MPa
Căldura de fuziune
15,52 kJ / mol
Căldura de vaporizare
41,57 kJ / mol
Capacitatea de căldură molară
54,44 J / (mol K)
Presiunea de vapori
Iodul are o presiune moderată a vaporilor și atunci când recipientul este deschis, acesta se sublimează încet până la vapori violet, iritant pentru ochi, nas și gât..
Numere de oxidare
Numerele de oxidare pentru iod sunt: -1 (I-), +1 (I+), +3 (I3+), +4 (I4+), +5 (I5+), +6 (I6+) și +7 (I7+). În toate sărurile de iod, ca și în cazul KI, iodul are un număr de oxidare de -1, deoarece în ele avem anionul I-.
Iodul capătă numere de oxidare pozitive atunci când este combinat cu elemente mai electronegative decât acesta; de exemplu, în oxizii săi (IDouăSAU5 și eu4SAU9) sau compuși interhalogenați (I-F, I-Cl și I-Br).
Electronegativitate
2,66 pe scara Pauling
Energie de ionizare
Prima: 1.008,4 kJ / mol
În al doilea rând: 1.845 kJ / mol
În al treilea rând: 3.180 KJ / mol
Conductivitate termică
0,449 W / (m K)
Rezistență electrică
1.39 107 Ω · m la 0 ºC
Ordinea magnetică
Diamagnetic
Reactivitate
Iodul se combină cu majoritatea metalelor pentru a forma ioduri și, de asemenea, cu elemente nemetalice, cum ar fi fosforul și alți halogeni. Ionul iodură este un puternic agent reducător, care eliberează spontan un electron. Oxidarea iodurii produce o nuanță maronie de iod.
Iodul, spre deosebire de iodură, este un agent oxidant slab; mai slab decât bromul, clorul și fluorul.
Iodul cu numărul de oxidare +1 se poate combina cu alți halogeni cu numărul de oxidare -1, pentru a da halogenuri de iod; de exemplu: bromură de iod, IBr. La fel, se combină cu hidrogenul pentru a da naștere la iodură de hidrogen, care după dizolvare în apă se numește acid hidroiodic..
Acidul hidroiodic este un acid foarte puternic capabil să formeze ioduri prin reacție cu metale sau oxizii, hidroxizii și carbonații acestora. Iodul are o stare de oxidare +5 în acidul iodic (HIO3), care este deshidratat pentru a produce pentoxid de iod (IDouăSAU5).
Structura și configurația electronică
- Atom de iod și legăturile sale

Iodul în starea sa de bază constă dintr-un atom care are șapte electroni de valență, doar unul dintre aceștia fiind capabili să-și completeze octetul și să devină izoelectronic cu gazul xenon nobil. Acești șapte electroni sunt dispuși în orbitalele lor 5s și 5p conform configurației lor electronice:
[Kr] 4d10 5sDouă 5 p5
Prin urmare, atomii I prezintă o tendință puternică de a se lega covalent, astfel încât fiecare individual are opt electroni în învelișul său exterior. Astfel, doi atomi I se apropie și formează legătura I-I, care definește molecula diatomică IDouă (imaginea de sus); unitate moleculară de iod în cele trei stări fizice ale sale în condiții normale.
Imaginea prezintă molecula IDouă reprezentat de un model de umplere spațială. Nu este doar o moleculă diatomică, ci și homonucleară și apolară; deci interacțiunile lor intermoleculare (IDouă - EuDouă) sunt guvernate de forțele de dispersie din Londra, care sunt direct proporționale cu masa lor moleculară și cu mărimea atomilor.
Această legătură I-I este totuși mai slabă în comparație cu cea a celorlalți halogeni (F-F, Cl-Cl și Br-Br). Acest lucru se datorează teoretic suprapunerii slabe a orbitalilor lor hibrizi sp3.
- Cristale
Masa moleculară a lui IDouă permite forțelor sale dispersive să fie direcționale și suficient de puternice pentru a stabili un cristal ortorombic la presiunea ambiantă. Conținutul său ridicat de electroni face ca lumina să promoveze tranziții de energie nesfârșite, ceea ce face ca cristalele de iod să se păteze de negru.
Cu toate acestea, atunci când iodul sublimează vaporii săi prezintă o culoare violetă. Acest lucru indică deja o tranziție mai specifică în interiorul orbitalilor moleculari ai IDouă (cei cu cea mai mare energie sau anti-link).
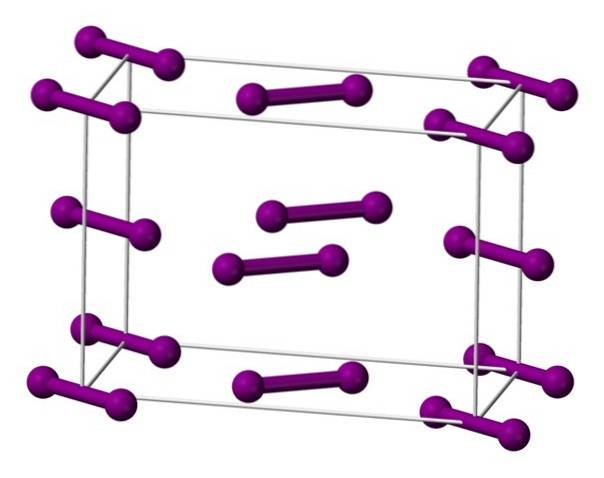
Moleculele I sunt prezentate mai susDouă, reprezentat printr-un model de sfere și bare, dispuse în interiorul celulei ortorombice.
Se poate observa că există două straturi: cel de jos cu cinci molecule, iar cel de mijloc cu patru. De asemenea, rețineți că o moleculă de iod se află la baza celulei. Sticla este construită distribuind periodic aceste straturi în toate cele trei dimensiuni..
Călătorind direcția paralelă cu legăturile I-I, se constată că orbitalii iodului se suprapun pentru a genera o bandă de conducere, ceea ce face din acest element un semiconductor; cu toate acestea, capacitatea sa de a conduce electricitatea dispare dacă se urmează direcția perpendiculară pe straturi.
Legați distanțele
Legătura I-I pare să se fi extins; și de fapt este, deoarece lungimea legăturii sale crește de la 266 pm (stare gazoasă), la 272 pm (stare solidă).
Acest lucru se poate datora faptului că în gaz moleculele IDouă sunt foarte îndepărtați, forțele lor intermoleculare fiind aproape neglijabile; în timp ce în solid, aceste forțe (I-I - I-I) devin tangibile, atrăgând atomii de iod ai două molecule vecine unul către celălalt și, prin urmare, scurtând distanța intermoleculară (sau interatomică, văzută într-un alt mod).
Apoi, când cristalul de iod se sublimează, legătura I-I se contractă în faza gazoasă, deoarece moleculele vecine nu mai exercită aceeași forță de atracție (dispersivă) asupra împrejurimilor lor. Și, în mod logic, distanța IDouă - EuDouă crește.
- Etape
S-a menționat mai devreme că legătura I-I este mai slabă în comparație cu ceilalți halogeni. În faza gazoasă la o temperatură de 575 ºC, 1% din moleculele IDouă se despart în atomi individuali de I. Există atât de multă energie termică încât doar doi I se reunesc din nou, se separă și așa mai departe.
În mod similar, această rupere a legăturii poate apărea dacă se aplică o presiune enormă pe cristalele de iod. Prin comprimarea acestuia prea mult (sub presiune de sute de mii de ori mai mare decât atmosferică), moleculele IDouă sunt rearanjate ca fază monatomică I, iar iodul se spune că prezintă caracteristici metalice.
Cu toate acestea, există și alte faze cristaline, cum ar fi: ortorombic centrat pe corp (faza II), tetragonal centrat pe corp (faza III) și cubic centrat pe față (faza IV).
Unde se găsește și se obține
Iodul are un raport de greutate, în raport cu scoarța terestră, de 0,46 ppm, ocupând locul 61 în abundență în acesta. Mineralele de iod sunt rare, iar depozitele de iod exploatabile comercial sunt iodate..
Mineralele de iod se găsesc în rocile magmatice cu o concentrație de 0,02 mg / kg până la 1,2 mg / kg și în rocile magmatice cu o concentrație de 0,02 mg până la 1,9 mg / kg. Poate fi găsit și în șistul Kimmeridge, cu o concentrație de 17 mg / kg în greutate.
Mai mult, mineralele de iod se găsesc în roci fosfat cu o concentrație cuprinsă între 0,8 și 130 mg / kg. Apa de mare are o concentrație de iod care variază de la 0,1 la 18 µg / L. Algele marine, bureții și stridiile erau în trecut principalele surse de iod.
În prezent, însă, principalele surse sunt caliciile, depozitele de azotat de sodiu din deșertul Atacama (Chile) și saramurile, în principal din zăcământul japonez de gaz din Minami Kanto, la est de Tokyo, și zăcământul de gaz Anadarko. Bazinul din Oklahoma (SUA).
Caliciul
Iodul este extras din calici sub formă de iodat și este tratat cu bisulfit de sodiu pentru a-l reduce la iodură. Soluția este apoi reacționată cu iod proaspăt extras pentru a facilita filtrarea acesteia. Caliche a fost principala sursă de iod în secolele XIX și începutul secolului XX..
Saramura
După purificare, saramura este tratată cu acid sulfuric, care produce iodură..
Această soluție de iodură reacționează ulterior cu clorul pentru a produce o soluție diluată de iod, care este evaporată de un curent de aer care este deviat către un turn de absorbție a dioxidului de sulf, producând următoarea reacție:
EuDouă + 2 oreDouăO + SODouă => 2 HI + HDouăSW4
Ulterior, gazul de iodură de hidrogen reacționează cu clorul pentru a elibera iodul în stare gazoasă:
2 HI + ClDouă => EuDouă + 2 HCI
Și, în cele din urmă, iodul este filtrat, purificat și ambalat pentru utilizare..
Rolul biologic
- Dieta recomandată
Iodul este un element esențial, deoarece intervine în numeroase funcții la ființele vii, care sunt cunoscute în special la om. Singura modalitate prin care iodul intră în om este prin mâncarea pe care o mănâncă.
Dieta recomandată pentru iod variază în funcție de vârstă. Astfel, un copil de 6 luni necesită un aport de 110 µg / zi; dar de la vârsta de 14 ani, dieta recomandată este de 150 µg / zi. În plus, se afirmă că aportul de iod nu trebuie să depășească 1.100 µg / zi.
- Hormoni tiroidieni
Hormonul stimulator al tiroidei (TSH) este secretat de glanda pituitară și stimulează absorbția de iod de către foliculii tiroidieni. Iodul este transportat în foliculii tiroidieni, cunoscuți sub numele de coloizi, unde se leagă de aminoacidul tirozină pentru a forma monoiodotirosină și diiodotirozină..
În coloidul folicular, o moleculă de monoiodotironină se combină cu o moleculă de diiodotironină pentru a forma o moleculă numită triiodotironină (T3). Pe de altă parte, două molecule de diiodotirozină se pot uni, formând tetraiodotironină (T4). T3 iar T4 se numesc hormoni tiroidieni.
Hormonii T3 Si t4 sunt secretate în plasmă unde se leagă de proteinele plasmatice; inclusiv proteine transportoare de hormoni tiroidieni (TBG). Majoritatea hormonilor tiroidieni sunt transportați în plasmă sub formă de T.4.
Cu toate acestea, forma activă a hormonilor tiroidieni este T3, deci T4 în „organele albe” ale hormonilor tiroidieni, acesta suferă deiodare și se transformă în T3 să-și exercite acțiunea hormonală.
Editarea efectelor
Efectele acțiunii hormonilor tiroidieni sunt multiple, fiind posibil să se sublinieze: metabolismul crescut și sinteza proteinelor; promovarea creșterii corpului și a creierului; creșterea tensiunii arteriale și a ritmului cardiac etc..
- Deficienta
Deficitul de iod și, prin urmare, al hormonilor tiroidieni, cunoscut sub numele de hipotiroidism, are numeroase consecințe care sunt influențate de vârsta persoanei.
Dacă deficitul de iod apare în timpul stării fetale a unei persoane, cea mai relevantă consecință este cretinismul. Această afecțiune se caracterizează prin semne precum afectarea funcției mentale, întârzierea dezvoltării fizice, strabism și întârzierea maturizării sexuale..
Un deficit de iod poate induce un guș, indiferent de vârsta la care apare deficitul. Un gușă este o supradezvoltare a tiroidei, cauzată de stimularea excesivă a glandei de către hormonul TSH, eliberat din hipofiză ca urmare a deficitului de iod..
Dimensiunea excesivă a tiroidei (gușa) poate comprima traheea, limitând trecerea aerului prin ea. În plus, poate provoca leziuni ale nervilor laringieni care pot duce la răgușeală..
Riscuri
Intoxicația de la un aport excesiv de iod poate provoca arsuri la nivelul gurii, gâtului și febră. De asemenea, dureri abdominale, greață, vărsături, diaree, puls slab și comă.
Un exces de iod produce unele dintre simptomele observate într-o deficiență: există o inhibare a sintezei hormonilor tiroidieni, care crește eliberarea de TSH, ceea ce duce la o hipertrofie a tiroidei; adică un gușă.
Există studii care indică faptul că aportul excesiv de iod poate provoca tiroidită și cancer tiroidian papilar. În plus, un aport excesiv de iod poate interacționa cu medicamentele, limitându-le acțiunea..
Aportul excesiv de iod în combinație cu medicamentele antitiroidiene, cum ar fi metimazolul, utilizat pentru tratarea hipertiroidiei, poate avea un efect aditiv și poate provoca hipotiroidism..
Inhibitorii enzimei de conversie a angiotensinei (ECA), cum ar fi benazepril, sunt utilizați pentru tratarea hipertensiunii. A lua prea mult iodură de potasiu crește riscul de hiperkaliemie și hipertensiune.
Aplicații
Medici
Iodul acționează ca un dezinfectant pentru piele sau rană. Are acțiune antimicrobiană aproape instantanee, pătrunzând în interiorul microorganismelor și interacționând cu aminoacizii de sulf, nucleotidele și acizii grași, ceea ce determină moartea celulară.
Acesta își exercită acțiunea antivirală în principal asupra virusurilor acoperite, postulând că atacă proteinele de pe suprafața virusurilor acoperite..
Iodura de potasiu sub formă de soluție concentrată este utilizată în tratamentul tirotoxicozei. Este, de asemenea, utilizat pentru a controla efectele radiațiilor provenite de la 131I prin blocarea legării izotopului radioactiv la tiroidă.
Iodul este utilizat în tratamentul cheratitei dendritice. Pentru a face acest lucru, corneea este expusă vaporilor de apă saturați cu iod, pierzând temporar epiteliul corneei; dar există o recuperare completă din aceasta în două sau trei zile.
De asemenea, iodul are efecte benefice în tratamentul fibrozei chistice a sânului uman. De asemenea, s-a subliniat că 131Aș putea fi un tratament opțional pentru cancerul tiroidian.
Reacții și acțiune catalitică
Iodul este utilizat pentru a detecta prezența amidonului, dând o nuanță albastră. Reacția iodului cu amidon este, de asemenea, utilizată pentru a detecta prezența bancnotelor contrafăcute tipărite pe hârtie care conține amidon..
Tetraiodomercuratul de potasiu (II), cunoscut și sub numele de reactiv Nessler, este utilizat în detectarea amoniacului. De asemenea, o soluție de iod alcalin este utilizată în testul de iodoform, pentru a arăta prezența metil cetonelor..
Iodurile anorganice sunt utilizate în purificarea metalelor, cum ar fi titanul, zirconiul, hafniul și toriul. Într-o etapă a procesului, trebuie formate tetraiodurile acestor metale.
Iodul servește ca stabilizator pentru colofoniu, ulei și alte produse din lemn.
Iodul este utilizat ca catalizator în reacțiile de sinteză organică de metilare, izomerizare și dehidrogenare. Între timp, acidul hidroiodic este utilizat ca catalizator pentru producerea de acid acetic în procesele Monsanto și Cativa..
Iodul acționează ca un catalizator în condensarea și alchilarea aminelor aromatice, precum și în procesele de sulfatare și sulfanare și pentru producerea de cauciucuri sintetice.
Fotografie și optică
Iodura de argint este o componentă esențială a filmului fotografic tradițional. Iodul este utilizat la fabricarea instrumentelor electronice, cum ar fi prismele monocristaline, instrumentele optice polarizante și sticla capabilă să transmită raze infraroșii..
Alte utilizări
Iodul este utilizat la fabricarea pesticidelor, a coloranților pentru anilină și a ftaleinei. În plus, este utilizat în sinteza coloranților și este un agent de stingere a fumului. Și, în cele din urmă, iodura de argint servește ca nucleu de condensare a vaporilor de apă din nori, pentru a provoca ploaie..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Stuart Ira Fox. (2003). Fiziologia umană. Prima editie. Editați | ×. McGraw-Hill Interamericana
- Wikipedia. (2019). Iod. Recuperat de pe: en.wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi și Onoda Mitsuko. (2003). Structura modulată a iodului solid în timpul disocierii sale moleculare sub presiune ridicată. Volumul naturii 423, paginile 971-974. doi.org/10.1038/nature01724
- Chen L. și colab. (1994). Tranziții structurale de fază ale iodului la presiune ridicată. Institutul de Fizică, Academia Sinica, Beijing. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider și Karl Christe. (26 august 2019). Iod. Encyclopædia Britannica. Recuperat de pe: britannica.com
- Dr. Doug Stewart. (2019). Fapte despre elementul de iod. Chemicool. Recuperat de pe: chemicool.com
- Centrul Național pentru Informații despre Biotehnologie. (2019). Iod. Baza de date PubChem. CID = 807. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Rohner, F., Zimmermann, M., Jooste, P., Pandav, C., Caldwell, K., Raghavan, R. și Raiten, D. J. (2014). Biomarkeri de nutriție pentru revizuirea iodului. Jurnalul nutriției, 144 (8), 1322S-1342S. doi: 10.3945 / jn.113.181974
- Advameg. (2019). Iod. Chimie explicată. Recuperat de pe: chemistryexplained.com
- Traci Pedersen. (19 aprilie 2017). Fapte despre iod. Recuperat de pe: livescience.com
- Megan Ware, RDN, LD. (30 mai 2017). Tot ce trebuie să știți despre iod. Recuperat de pe: medicalnewstoday.com
- Institutul Național de Sănătate. (9 iulie 2019). Iod. Recuperat de la: ods.od.nih.gov



Nimeni nu a comentat acest articol încă.